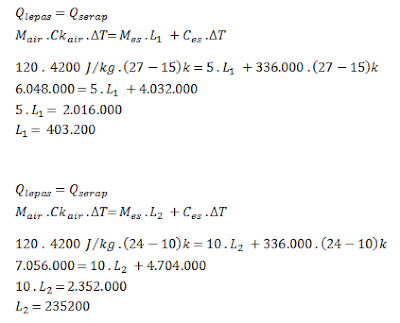LAPORAN PRAKTIKUM FISIKA DASAR
KEGIATAN : III KALORIMETER
Disusun oleh :
Kelompok : 1
Semester / Kelas : III / 3A
Anggota Kelompok :
Dhio Fathi Rabbani (1815500011)
Indri Puspita Sari (1815500019)
Nurma Yuniarsih (1815500001)
Rizki Rismawati (1815500027)
Windi Widiawati (1815500004)
Dosen Pengampu : Retna Kusuma Astuti M.Sc.
PRODI PENDIDIKAN IPA
FAKULTAS KEGURUAN DAN ILMU PENDIDIKAN
UNIVERSITAS PANCASAKTI TEGAL
I. PENDAHULUAN
1.1 Latar Belakang
Kalor merupakan salah satu bentuk energi, maka kalor merupakan besaran fisika yang memiliki satuan. Kalor tidak dapat dilihat oleh mata, tetapi pengaruhnya dapat kita rasakan atau kita ketahui. Pengukuran –
pengukuran kalor sangat berkaitan dengan kalor jenis zat. Pengukuran kalor menggunakan alat yang dinamakan kalorimeter. Kalorimeter terdiri dari sebuah bejana logam yang kalor jenisnya sudah diketahui.
Dengan kalorimeter dapat mengukur kalor jenis suatu zat. Dan dengan kalorimeter dapat mengetahiu bahwa adanya kalor dapat mengubah wujud zat. Sedangkan aplikasi penggunaan kalorimeter dalam kehidupan sehari – hari misalnya setrika listrik, rice cooker dan lain sebagainya. Dimana alat – alat tersebut mempunyai prinsip kerja yaitu energi listrik diubah menjadi kalor seperti pada kalorimeter.
1.2. Tujuan
- Menentukan kapasitas kalor kalorimeter alumunium
- Menentukan kalor jenis suatu logam
- Menentukan kalor lebur es
1.3. Waktu dan Tempat
Hari / Tanggal : Senin, 10 Oktober 2016
Pukul : 08.00 - Selesai
Tempat : Laboratorium Fisika
II. TINJAUAN PUSTAKA
1.1. Pengertian Kalorimeter
Kalorimeter adalah alat yang digunakan untuk mengukur kalor jenis suatu zat. Menggunakan teknik pencampuran dua zat didalam suatu wadah. Jika kalor jenis zat diketahui, kalor jenis zat lain yang dicampur dengan zat tersebut dapat dihitung. Energi ternal adalah energi kinetik acak dari partikel yang menurun suatu sistem panas . Q adalah energi ternal yang berpindah dari suatu sistem yang lain yang mengalami kontak dengannya, tetapi benda pada temperatur yang lebih rendah. Satuannya adalah Joule. Dalam mekanisme penyerapan atau pelepasan kalor oleh suatu benda berlaku hukum kekekalan energi “ Kalor yang dilepaskan akan sama dengan kalor yang diserap “. Pernyataan tersebut diungkapkan oleh Joseph Black dan dikenal istilah Asas Black :
Q serap = Q lepas
1.2. Kapasitas Kalor
Bila sejumlah kalor atau energi panas diberikan pada suatu zat, maka suhu zat itu tentu akan naik (kecuali pada saat perubahan wujud, misalnya air menguap atau es mencari). Banyaknya kalor (Q) yang diperlukanuntuk menaikkan suhu suatu zat sebanding dengan perubahan temperatur (delta T ) zat tersebut. Secara matematis dapat ditulis,
Q = C. delta T
dengan C merupakan kapasitas kalor zat.
Kapasitas kalor didefinisikan sebagai banyaknya kalor atau energi panas yang dibutuhkan untuk menaikkan suatu benda sebesar atau . Oleh karena satuan untuk kalor adalah joule dan satuan suhu adalah kelvin, maka satuan untuk kapasitas kalor adalah Joule / Kelvin .
1.3. Kalor Jenis
Kalor jenis suatu zat didefinisikan sebagai banyaknya kalor yang diperlukan untuk menaikkan suhu 1 kilogram. Zat itu sebesar 1 derajat celcius atau 1 derajat kelvin. Atau dengan kata lain, banyaknya kalor (Q) yang diperlukan untuk menaikkan suhu suatu zat sebanding dengan perubahan temperatur (delta T) dan massa (m) zat tersebut. Secara matematis hubungan tersebut :
Q = m c delta T
dengan: m massa zat dan c : kalor jenis.
Berdasarkan persamaan tersebut, maka satuan jenis suatu zat adalah Joule/kg.k (j/kg.k) Kalor jenis suatu zat merupakan sifat termal zat terhadap kemampuannya menyerap kalor. Nilai kalor jenis zat tentu akan beragam, tergantung pada kemampuan masing - masing zat dalam menyerap kalor.
1.4. Kalor Laten
Bila sejumlah kalor ditambahkan pada suatu zat akan menyebabkan kenaikan suhu zat tersebut. Bila kalor tersebut terus menerus ditambahkan kalor, maka suatu ketika zat tersebut akan berubah wujud. Kalor yang diperlukan oleh suatu zat untuk berubah wujud dinamakan Kalor Laten (L), dan besarnya kalor laten ini berbeda – beda, tergangung dari jenis zatnya. Besarnya kalor yang diperlukan pada perubahan wujud suatu benda dinyatakan :
Q = m.L
dengan L merupakan kalor laten
Nilai kalor laten zat ini bergantung dari proses perubahan wujud yang terjadi. Pada saat benda melebur, maka kalor laten yang digunakan adalah kalor laten lebur atau kalor beku. Pada saat benda menguap, maka kalor laten yang digunakan adalah kalor laten didih dan biasanya disebut kalor didih atau kalor uap.
III. METODE
3.1 Alat dan Bahan
Nama Alat Jumlah
Termometer (2 buah)
Beakaer Alumunium (1)
Isolasi Pelindung (1)
Neraca 4 Lengan (1)
Gelas Kimia (1)
Pembakar Spirtus (1)
Klem / Bosshead Universal (1)
Dasar Statif (1)
Kaki Statif (1)
Batang Statif Panjang (1)
Batang Statif Pendek (2)
Klem Penjepit (1)
Kubus Logam (1)
Es Batu (secukupnya)
3.2 Cara Kerja
A. Kapasitas Kalor
- Menyiapkan alat - alat percobaan kapasitas kalor kecuali kubuslogam dan es batu dan merangkai alat percobaan.
- Menimbang kalorimeter kosong kemudian mengisi dengan air sehingga bagian dan menimbang lagi.
- Menentukan massa air tersebut. Kemudian mengukur suhu kalorimeter dan air tersebut sebagai
- Mengisi gelas kimia dengan air hingga bagian kemudian mempanaskan perlahan – lahan hingga merata dan mencatat suhu air yang dipanasi tersebut sebagai .
- Menuangkan air panas sebelumnya kedalam kalorimeter mengaduk perlahan – lahan sehingga mencapai suhu kesetimbangan .
- Menimbang kembali kalorimeter bersama air campuran.
- Mengulangi langkah 1 – 5 dengan suhu air dipanasi. Bervariasi (minimal 3 kali)
B. Kalor Jenis
- Menyiapkan alat – alat percobaan dan merangkai alat percobaan.
- Mengikat kubus logam dengan benang kemudian menimbang massanya.
- Mengisi gelas kimia dengan air sehingga bagian kemudian menggantungkan kubus didalam gelas kimia sehingga logam tercelup seluruhnya dan memanaskan hingga mendidih. Mencatat suhunya .
- Menimbang beaker alumunium kosong, mencatat massanya mk.
- Mengisi beaker alumunium dengan air bagian kemudian menimbang, dan mencatat suhunya .
- Mengangkat logam air mendidih kemudian memasukkan ke dalam kalorimeter.
- Mengaduk – aduk perlahan logam ke dalam air sampai suhunya konstan dan mencatat suhu akhir tersebut .
C. Kalor Lebur ES
- Mempersiapkan peralatan dan merangkai alat.
- Menimbang beaker alumunium kosong, mencatat massanya mk.
- Mengisi beaker alumunium dengan air bagian kemudian menimbang, dan mencatan suhu .
- Memasukkan sepotong es yang sudah dikeringkan dengan kertas saring kedalam kalorimeter dan mengaduk – aduk sampai merata, tepat setelah es mencari seluruhnya. mencatat suhu akhirnya
- menimbang kalorimeter plus air es .
- mengulangi langkah 15 – 19 dengan variasi massa es dengan massa air dalam beaker alumunium tetap.
IV. HASIL DAN PEMBAHASAN
4.1 Data Pengamatan
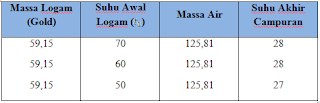
B. Kalor Jenis
C. Kalor Lebur Es
4.2 Analisa Data
4.3 Pembahasan
Dari percobaan yang telah dilakukan dan dituliskan hasilnya dalam bentuk tabel diatas maka dapat diketahui jenis bahan yang berpengaruh terhadap kalor jenis yang dihasilkan. Bahan yang sama dapat memberikan perbedaan besar kalor jenis, jika suhunya berbeda. Suhu awal logam , suhu yang dipakai pada percobaan ini semakin menurun. Massa air yang dipakai sama 125,81. Bahan yang dipakai gold dengan 3x tahap percobaan dengan variasi suhu yang berbeda – beda.
Pada kalor lebur es, percobaan ini menggunakan variasi massa es yang berbeda – beda dengan selisih 5kg, massa air yang digunakan tetap 120. Semakin banyak massa es yang digunakan maka semakin rendah suhu air campuran tersebut.
Pada kapasitas kalor, percobaan ini menggunakan variasi suhu air yang dipanasi ( ). Suhu akhir dengan suhu awal pada saat menimbang massa kalorimeter yang berbeda – beda, dikarenakan massa kalorimeter yang digunakan berbeda – beda, kalorimeter yang digunakan pada percobaan ini ada 2.
Pada hasil praktikum ini telah sesuai dengan Asas Black yang berbunyi “ Jumlah kalor yang dilepas sama dengan jumlah kalor yang diserap “. Dimana jumlah kalor yang dilepas oleh bahan gold, es, air panas sama dengan jumlah kalor yang diterima oleh air. Sehingga akhirnya mencapai suhu tetap yang tidak berubah naik atau turun lagi.
V. PENUTUP
a. Kesimpulan
Adapun kesimpulan yang didapat setelah melakukan praktikum ini, antara lain :
- Semakin mudah bahan menghantarkan panas, maka kalor jenis bahan semakin besar. Hampir semua suhu akhir baik peercobaan menentukan kalor jenis menghasilkan setengah dari suhu awal.
- Suhu akhir pada kalor lebur menghasilkan hampir setengah dari suhu awal. Massa air yang dipakai sama.
- Suhu akhir pada kapasitas kalor menghasilkan hamper setengah dari suhu awal. Massa kalorimeternya berbeda-beda, dikarenakan massa kalorimeternya berbeda-beda.
- Praktrikum ini tentang kalor dapat dibilang telah sesuai dengan Asas Black.
b. Saran
Pada praktikum ini praktikum harus sudah memahami cara kerja dengan baik agar mengulang praktikum karena kesalahan cara kerja. Namun keberuntungannya kesalahan tidak berakibat fatal. Untuk kedepannya semoga praktikum berjalan dengan lancar.
DAFTAR PUSTAKA
Diktat praktikum fisika Pendidikan IPA UNIVERSITAS PANCASAKTI TEGAL